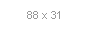Кристалізація, перехід речовини з газоподібного (пароподібного), рідкого або твердого аморфного стану в кристалічний, а також з одного кристалічного стану в інше (рекристалізація, або вторинна кристалізація); фазовий перехід першого роду. Кристалізація з рідкої або газової фази - екзотермічний процес, при якому виділяється теплота фазового переходу, або теплота кристалізація; при цьому зміна ентропії в більшості випадків становить [в Дж / (моль.К)]: для простих речовин 5-12, для неорганічних сполук 20 - 30, для органічних сполук 40-60. Рекристалізація може протікати з виділенням або поглинанням теплоти. У промисловості і лаб. практиці кристалізація використовують для отримання продуктів із заданими складом, вмістом домішок, розмірами, формою і дефектностью кристалів (Див. дефекти . кристалічна структура . Кристали), а також для фракційного поділу сумішей, вирощування монокристалів та ін.
Фізико-хімічні основи процесу. Умови, при яких можлива кристалізація, визначаються видом діаграми стану . Щоб кристалізація протікала з кінцевою швидкістю, вихідну фазу необхідно переохолодити (перегріти), переситіть речовини, що кристалізується або внести у зовн. поле, що знижує розчинність кристалізується фази. У переохолодженої (перегрітої) або пересичені фазі відбувається зародження нової фази - утворюються центри кристалізація, які перетворюються в кристали і ростуть, як правило, змінюючи форму, зміст домішок і дефектність. Центри кристалізація виникають гомогенно в обсязі початкової фази і гетерогенно на поверхнях сторонніх твердих частинок (первинне зародкоутворення), а також поблизу поверхні раніше сформованих кристалів нової фази (вторинне зародкоутворення). Загальна кількість центрів кристалізація, що виникли в одиниці об'єму розчину або розплаву в 1 с, або сумарну інтенсивність їх первинного та вторинного освіти, знаходять за формулою:
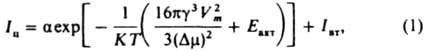
де a - кінетичний коефіцієнт первинного зародкоутворення, який розглядають в рамках кінетичної теорії утворення нової фази; R - газова постійна . T - температура кристалізація; у - питома поверхнева вільна енергія кристалів; V т - молярний об'єм нової фази; Dm = DHS і S = (Т0-7) / Т0 для розплавів, am = RT1n (S + 1) і S = (c-c0) / c0 для розчинів; DH-ентальпія кристалізація; с - концентрація речовини, що кристалізується; Т0 і c0 - соотв. температура плавлення речовини і концентрація насиченого розчину; Eакт - енергія активації переходу молекул з середовища в центри кристалізація; Iат - інтенсивність вторинного зародкоутворення в обсязі початкової фази. Для вимірювання a, Eaкт і Iвт знаходять залежність інтенсивності утворення центрів кристалізація від температури, перенасичення і концентрації сторонніх твердих частинок.
Величина I та проходить через один або нескрісталлізація максимумів (рис. 1) зі зростанням переохолодження (пересичення) і збільшується при хутро. впливах (перемішування,
Мал. I Залежність швидкості зародкоутворення від переохолодження розплаву InSb: I розплав масою 16 г перегрівався в кварцовому тиглі на 15 К вище температури плавлення протягом 9 хв і потім охолоджувався зі швидкістю 1 град / хв; 2 той же, на 55 К протягом 20 з під впливом іонізуючого випромінювання . при зростанні кристалів спочатку кристалізується речовина адсорбується на поверхні сформованого кришталика, а потім вбудовується в його кристалічну решітку: при сильному переохолодженні равновероятно на будь-якій ділянці поверхні (нормальний ріст), при слабкому - шарами тангенциально на ступенях, утворених гвинтовими дислокациями або двомірними зародками (пошарове зростання). Якщо переохолодження нижче деякого значення, називають межею морфологічної стійкості, нормально зростаючий кристал повторює форму (зазвичай округлу) теплового або концентраційного поля навколо нього, а пошарово зростаючий кристал має форму багатогранника. При перевищенні вказаної межі ростуть деревовидні кристали (дендрити). кількісно зростання кристалів характеризують лінійної швидкістю, яка дорівнює швидкості переміщення їх поверхні в нормальному до неї напрямі. У промисловості використовують ефективну лінійну швидкість росту (збільшення в 1 з радіусу кулі, обсяг якого дорівнює обсягу кристала): Iефф = bSnехр (Eр / RT), де b - кінетичний коефіцієнт зростання (10-5-10-14 м / с), n-параметр зростання (зазвичай 1-3), Ер - енергія активації зростання (10-150 кДж / моль). Параметри b, n і Eр знаходять, вимірюючи Iефф при різних температурах і пересиченнях розчину або переохолодженнях розплаву. Зі збільшенням переохолодження Iефф проходить через максимум аналогічно Im. Швидкість зростання може лімітувати масо-і теплообміном кристалів із середовищем (соотв. внешнедіффузіонний і теплообмінний режими зростання), швидкістю хімічної взаємодії кристалізується компонента з іншими компонентами середовища (внешнекінетіческій режим) або процесами на поверхні кристалів (Адсорбционно-кінетичний режим). У внешнекінетіческом режимі Iефф зростає з підвищенням концентрацій реагентів і каталізаторів . у внешнедіффузіонном і теплообмінному режимах - зі збільшенням інтенсивності перемішування, в адсорбційно-кінетичному режимі - зі зростанням поверхневої дефектності кристалів і зменшенням концентрації ПАР.
При високих швидкостях росту кристали набувають значну кількість нерівноважних дефектів (вакансій, дислокацій та ін.). При перевищенні меж морфологічної стійкості в обсяг кристалів потрапляють тривимірні включення середовища, замуровані між гілками дендритів (оклюзія). склад кристалів через оклюзії наближається до складу середовища тим більше, чим вище Iефф. При своєму зрості кристали захоплюють будь-яку присутню в середовищі домішка, причому концентрація захопленої домішки залежить від швидкості росту. Якщо кристалізація відбувається в розчині і кристали після завершення росту продовжують контактувати із середовищем, то нерівноважної захоплена домішка викидається з кристалів в середу, а їх структура вдосконалюється (структурна перекристалізація). Одночасно в переміли середовищі при зіткненнях кристалів один з одним і зі стінками кристалізатора виникають додаткові структурні дефекти. Тому в системі поступово встановлюється стаціонарна дефектність кристалів, яка залежить від інтенсивності перемішування. У наиб. поширеному випадку освіти при кристалізація безлічі кристалів (Масова кристалізація) виділяється фаза полідисперсна, що обумовлено неодновременностью зародження кристалів і флуктуаціями їх зростання. Дрібні кристали більш розчинні, ніж великі, тому при спадному пересиченні настає момент, коли середовище, залишаючись пересичені щодо останніх, становітcя
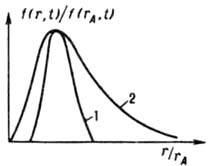
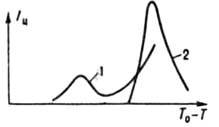
Мал. 2. Функція розподілу кристалів за розмірами (звичайним r і наиб. імовірним rA) при ізотермічної (298 К) періодичної кристалізації з водного розчину в кристалізаторі з мішалкою (число Re = 104): 1 BaSO4, вихідне пересишеніе S0 = 500. rA = 7.6 мкм; 2 - K2SO4, висолювання метанолом (1.1) rA = 1 мкм; t час процесу.
З цього моменту починаються їх розчинення і зростання великих кристалів (Освальдoво дозрівання), в результаті чого середній розмір кристалів зростає, а їх число зменшується. Одночасно в переміли середовищі кристали розколюються при зіткненнях і через деякий час набувають стаціонарну дисперсність, яка визначається інтенсивністю механічного впливу. Осн. кількостей, характеристика масової кристалізація - функція розподілу кристалів за розміром f (r, t) = dN / dr, де N - число кристалів, розмір яких менше поточного розміру r, в одиниці об'єму в момент t. Ця функція часто має колоколообразний вид (рис. 2); висхідна її гілка чутлива в основному до зародкоутворення, зростання, розколювання і розчинення (при дозріванні) кристалів, спадна до росту і утворення їх агрегатів. Якщо середнє квадратичне відхилення розміру кристалів від середнього не перевищує половини, останнього, згадана функція зв. вузької, якщо перевищує - широкою. Зміна функції f (r, t) при кристалізація описується рівнянням:
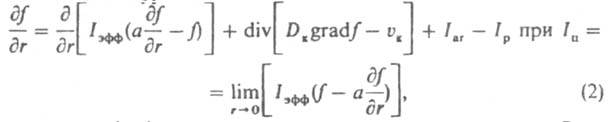
де a - коефіцієнт флуктуації швидкості росту кристалів; Dк і v до - соотв. коефіцієнт дифузії і швидкість переміщення кристалів у середовищі; Iar і Iр - соотв. інтенсивність освіти кристалів даного розміру за рахунок злипання більш дрібних частинок і розколювання кристалів.
При пeріодіч. процесі швидкість кристалізація, яка визначається за формулою:
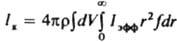 ,
,
де r і V - соотв. щільність твердої фази і обсяг системи, спочатку повільно зростає (період індукції), потім різко збільшується в результаті одночасного зростання r і f і, пройшовши через максимум, зменшується (рис. 3) внаслідок зниження Iефф. У періоди індукції і збільшення швидкості кристалізація в системі переважають зародження і зростання кристалів, в період зменшення швидкості - їх зростання, агрегація і розколювання і далі - освальдово дозрівання і структурна перекристалізація. Період індукції скорочується під впливом чинників, які прискорюють зародкоутворення і зростання кристалів. Так, при охолодженні розплавів цей період з підвищенням інтенсивності охолодження спочатку зменшується, а потім
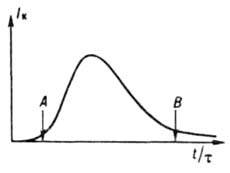
Мал. 3. Типове зміна швидкості періодичної кристалізації: t - час процесу; t - тривалість періоду індукції; A - моментпоявленія нової фази; В - початок стадії структурної перeкрісталлізаціі і освальдова дозрівання зростає через екстремальну залежності швидкостей зародження і зростання кристалів від переохолодження; якщо темп охолодження досить великий, розплав твердне, залишаючись аморфним (див. Стеклообразное стан). Для скорочення періоду індукції в систему додають кристали продукту (затравки), які ростуть, що призводить до збільшення швидкості кристалізація В результаті виділення при зростанні кристалів теплоти кристалізація знижується переохолодження і сповільнюється зародкоутворення. При малих переохолодженнях (пересиченнях) зародки взагалі не виникають, і запал, введена в систему у вигляді поодиноких кристалів, може вирости в монокристал, а у вигляді порошку - в так званий монодисперсні продукт з вузькою функцією f (r, t).
У хім. і суміжних галузях промисловості, а також в лабораторіях переважно застосовують кристалізація з розплавів і розчинів, рідше - кристалізація з парової і твердої фаз. Кристалізацію з розплавів використовують головним чином для затвердіння розплавлених речовин і, крім того, для їх фракційного поділу і вирощування монокристалів . Отверждение речовин у вигляді виливків (блоків) здійснюють в спеціальних формах. У малотоннажних виробництвах (напр., Реактивів) зазвичай застосовують окремі форми певних розмірів або конфігурації, в яких розплав охолоджується шляхом природного теплообміну з навколишнім середовищем; в великотоннажних виробництвах (нафталіну і ін.) кристалізація проводять в секціонованих, трубчастих, конвеєрних та інших кристалізаторах з вбудованими формами, примусово охолоджуваними водою, рідким NH3, хладонами і т.п.
Для отримання продуктів у вигляді тонких пластинок або лусочок використовують безперервно діючі стрічкові, вальцеві і дискові кристалізатори, де затвердіння відбувається значно інтенсивніше, ніж в формах. У стрічковому кристалізаторі (рис. 4) вихідний розплав
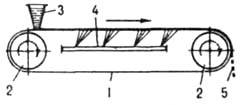
Мал. 4. Стрічковий кристаллизатор: 1 стрічка; 2 приводні барабани; 3 живить бункер; 4 охолоджувальний пристрій; 5 отвердний продукт тонким шаром подається на рухому металеву стрічку, на якій він охолоджується до повного затвердіння. У вальцевого апараті (рис. 5) продукт кристалізується на зовнішній поверхні охолоджуваного зсередини обертового полого барабана (вальца), частково зануреного в ванну з розплавом; кристали знімаються з барабана нерухомим ножем. В дискових апаратах затвердіння продуктів відбувається на поверхні охолоджуваних зсередини обертових дисків.
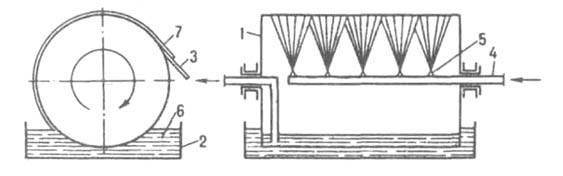
Мал. 5. вальцевого кристаллизатор: 1 барабан; 2 ванна; 3 ніж; 4 труба для подачі холодоагенту; 5 форсунка; 6 розплав; 7 отвердний продукт.
При приготуванні гранулювання продуктів розплав диспергируют безпосередньо в потік холодоагенту газоподібного, в основному повітря (виробництво аміачної селітри, карбаміду і ін.), Або рідкого, наприклад води або масла (виробництво пластмас, сірки і т. П.) В порожнистих баштах або апаратах з псевдоожнжeнним шаром, де кристалізуються дрібні краплі розплаву
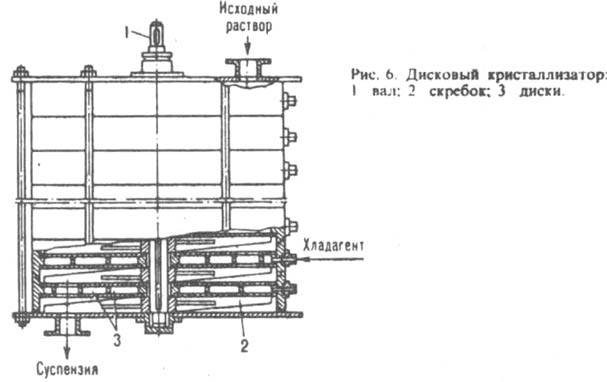
Дискові кристалізатори забезпечені нерухомими або обертовими дисками. У першому випадку (рис. 6) по осі апарату розташований приводний вал зі шкребками для очищення поверхонь дисків від осаждающихся кристалів; вихідний розчин подається в кристалізатор зверху, а що утворюється суспензія послідовно проходить в просторі між охолоджуваними дисками і вивантажується через нижній штуцер. У другому випадку вал з дисками розміщений всередині корита або горизонтального циліндричного судини; кристали знімаються з поверхні дисків нерухомими скребками.
Основний елемент барабанного кристалізатора - порожнистий барабан з опорними бандажами, встановлений під кутом 15 ° до горизонтальної осі і обертається з частотою 5-20 хв-1. Розчин, що охолоджується водяною сорочкою або повітрям (який нагнітають вентилятором через внутрішню порожнину барабана), надходить з одного його кінця, а суспензія відводиться з іншого.
При вікорістанні скребкових, шнекові, роторних и іноді дискових кристаллизаторов часто утворюються дрібні кристали (0,1-0,15 мм), что виробляти до Збільшення злежуваності и адсорбційного забруднення продукту, а такоже погіршує его фільтрованість. Тому для укрупнення крісталів продукту после згаданіх апаратів встановлюються так звані крісталлорастворітелі, в якіх концентрована суспензія витримується при повільному охолодженні, что виробляти до зростання крісталів до 2-3 мм.
Для Отримання крупнокрісталліческіх однорідніх продуктів часто застосовують крісталізаторі з псевдозрідженім кулею (рис. 7). Вихідний розчин разом з ціркулюючім освітленім маточником подається насосом в теплообмінник, де в результате охолодження розчин пересіщается и Надходить по ціркуляційної трубі в нижню часть крісталлорастворітеля, в якому кристали підтрімуються в підвішеному стані вісхіднім потоком розчин. Кристалізація відбувається в основному на готових центрах кристалізації, при цьому великі кристали осідають на дно апарату, звідки їдуть у вигляді згущення суспензії. Освітлений маточник розділяється на дві частини: одна відводиться з верхньої частини апарату, інша подається на рециркуляцію.
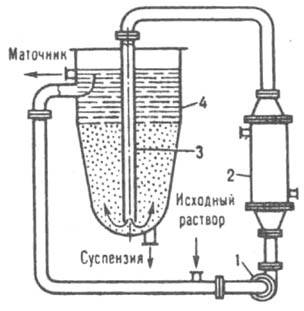
Мал. 7. Кристаллизатор з псевдоожіженмим шаром: I насос: 2 теплообмeннік: 3 циркуляційна труба; 4 крісталлорастворітель.
У ряді cлучаев кристалізація розчинів здійснюють безпосереднім змішуванням їх з рідкими, газоподібними і випаровуються холодоагентами в змішувальних, барботажних, розпилювальних та ін. Апаратах. Якщо розчинність речовини мало змінюється зі зміною температури (напр., NaCl у воді), кристалізація проводять частковим або практично повним випаровуванням растворітeля шляхом випарювання насиченого розчину при майже постійній температурі (ізотермічна кристалізація). За конструкцією випарні кристалізатори в значній мірі нагадують випарніапарати і можуть мати внутрішню або виносну (рис. 8) гріють камери. В такому кристаллизаторе вихідний і циркулює розчини, проходячи через камеру, нагріваються до температури кипіння. Новоутворена парожидкостная суміш надходить в сепаратор, де пар відокремлюється від розчину. Кристали, що осідають в сепараторі, разом з маткової рідиною спрямовуються до спеціального апарат, в якому відокремлюються від неї і виводяться у вигляді концентрованої суспензії;
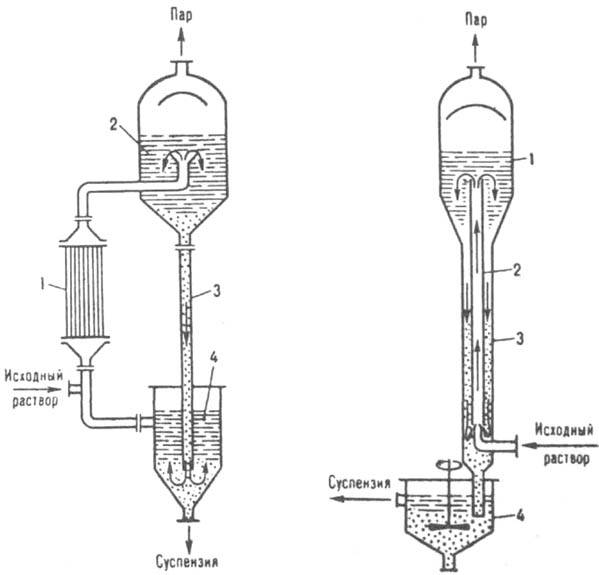
Мал. 8. Випарний кристалітів гір: 1 виносна гріє камера: 2 сепаратор: 3 циркуляційна труба; 4 відділювач кристалів.
Мал. 9. Вакуум-кристалізатор: 1 - сепаратор: 2 - циркуляційна труба: 3 барометрична труба; 4 гідрозатвор
освітлений маточник повертається в камеру. Для запобігання інкрустації (обростання) поверхонь нагріву розчин повинен циркулювати в кристалізаторі з досить великою швидкістю (до 3 м / с), що часто досягається застосуванням осьових насосів.
Кристалізацію деяких речовин можна здійснити висолюванням. При виділенні неорганічних сполук використовують органічні речовини (напр., Na2SO4 кристалізують, додаючи до його водного розчину метанол, етанол або NH3) або містять однаковий іон з виділеним з'єднанням (напр., FeSO4 кристалізують з травильних розчинів добавкою концентрованої H2SO4); при виділенні орг. з'єднань - воду, водні розчини неорганічних солей і т. п. Введення в розчин в якості висалівателей органічних речовин зазвичай здорожує процес через складність їх регенерації. Кристалізація з парової фази дозволяє кристалізувати речовини, що володіють високим парціальним тиском парів над твердою фазою і здатні безпосередньо переходити з газоподібного стану в кристалічний (наприклад, йод, фталевий ангідрид). Таку кристалізацію використовують для виділення цінних компонентів з парогазових сумішей, отримання аерозолів, нанесення тонких кристалічних шарів на поверхню різних тіл (напр., У виробництві напівпровідникових матеріалів) і т.д. Кристалізацію аморфної твердої фази і рекристалізацію здійснюють, як правило, при температурах, близьких до температур плавлення кристаллизуемой речовин. При цьому в результаті термодіффузіонного процесів змінюється первинна кристалічна структура речовини або відбуваються зародження і зростання крісталів з аморфної фази. Таку кристалізація застосовують для отримання речовин і матеріалів із заданими кристалічною структурою або ступенем кристалічності (термопластичні полімери, скло та ін.). Літ .: Маллин Дж.У .. Кристалізація, пров. з англ., М., 1965; Магусевіч Л.М .. Кристалізація з розчинів в хімічній промисловості, М., 1968; Бемфорт А В, Промислова кристалізація, пров. з англ., М., 1969; Пономаренко В. Г. Ткаченко кристалізація П., Курлянд Ю. А., Кристалізація в псевдозрідженому шарі. кристалізація, 1972; Меліхов І. В., Меркулова М.С .. Співкристалізація, М .. 1975; Гельперин Н. І .. Носов Г. А., Основи техніки кристалізації розплавів, М., 1975; Кідяров Б. І., Кінетика утворення крісталів з рідкої фази, Новосиб., 1979; Гельперин Н. І., Основні процеси і апарати хімічної технології, кн. 2, М., 1981, с. 678 726, Контактна кристалізація, під ред. М.Ф. Михалева. Л., 1983; Тодес О. М., Себалло В. А .. Гольцікер А. Д., Масова кристалізація з розчинів. Л., 1984; Гельперин Н. І., Носов Г. А .. Основи техніки фракційної кристалізації. М., 1986. © І. В. Меліхов. Г. А. Носов.